ESTILO DE VIDA E IMPACTO EN EL CONTROL DE FACTORES DE RIESGO CARDIOVASCULAR EN PACIENTES CORONARIOS EN 27 PAÍSES: RESULTADOS DEL REGISTRO EUROASPIRE V DE LA SOCIEDAD EUROPEA DE CARDIOLOGÍA.
Por Dr. Nicolás Chichizola.
Presidente del Comité de Cardiología del Ejercicio 2020.
Dra. Carolina Chacón.
Autora: Dra. Cristina B. Sorribas
1- ¿Hay estadísticas en nuestro país sobre incidencia y morbimortalidad relacionadas con hipertensión y embarazo?
ARTÍCULOS COMENTADOS POR COMITÉS
ARTÍCULOS COMENTADOS POR COMITÉS
Comité de Cardiopatías Congénitas 2020
Autor: Juan Pablo Argüello.
Pregnancy in Women with Complex Congenital Heart Disease. A Constant Challenge
Avila WS, Ribeiro VM, Rossi EG, et al. Arq Bras Cardiol. 2019; 113(6):1062-1069
La mejora en las técnicas quirúrgicas ha contribuido a un número creciente de mujeres en edad fértil con cardiopatía congénita compleja (CCC). Sin embargo, el asesoramiento adecuado sobre el embarazo en esta situación es incierto, debido a una amplia variedad de lesiones cardíacas residuales.
ARTÍCULOS COMENTADOS POR COMITÉS
Comité de Arritmias y Electrofisiología
Dr. Sebastián Nannini
LA TAN ESPERADA PUBLICACIÓN DEL ESTUDIO CABANA.
Efecto de la Ablación por Catéter vs Tratamiento con Drogas Antiarrítmicas en mortalidad, stroke, sangrado y paro cardíaco entre pacientes con Fibrilación Auricular.
Effect of Catheter Ablation vs Antiarrhythmic Drug Therapy on Mortality, Stroke, Bleeding, and Cardiac Arrest Among Patients With Atrial Fibrillation: The CABANA Randomized Clinical Trial.
Packer DL, Mark DB, Robb RA, et al.
JAMA. 2019;321(13):1261-1274.
Después de mucho tiempo llegó el momento de la publicación del estudio CABANA, esperado tanto por cardiólogos como por electrofisiólogos. Este se trata de un estudio multicéntrico (126 centros en 10 países), abierto, randomizado, cuyo objetivo fue determinar si la ablación por catéter de la Fibrilación Auricular (FA) es más efectiva que el tratamiento farmacológico habitual para disminuir eventos cardiovasculares y mortalidad.
Se randomizaron 2204 pacientes (p) con FA sintomáticos desde el 11/2009 al 04/2016. Los criterios de inclusión fueron: p mayores de 65 años o menores con 1 o más factores de riesgo para ACV y que sean candidatos para ablación o tratamiento médico que controle ritmo o frecuencia. Se excluyeron aquellos p con ablación previa o refractarios a 2 o más fármacos antiarrítmicos.
La ablación consistió en el aislamiento de las venas pulmonares quedando otras técnicas a discreción de cada centro. Los médicos operadores debían tener más de 100 procedimientos de experiencia. Todos los p debían recibir anticoagulación según las guías.
El punto final primario fue un combinado de muerte, ACV discapacitante, sangrado serio y paro cardíaco y de los 13 puntos finales secundarios sólo se informaron en este artículo mortalidad por todas las causas, mortalidad total u hospitalización cardiovascular (CV) y recurrencia de FA.
El seguimiento se realizó a los 3, 6 y 12 meses y luego cada 6 meses. Los eventos fueron revisados y adjudicados en forma ciega por un comité independiente. Para registrar la recurrencia se les dio a los p una grabadora de eventos activada por síntomas o automáticamente durante el día y con un holter de 96 hs cada 6 meses. Cualquier episodio de FA de más de 30 segundos se consideró recurrencia. Se definió un período de blanking de 3 meses en ambos grupos donde no se buscaron recurrencias.
Resultados:
Un total de 2204 p fueron randomizados a ablación (1108 p) o fármacos (1096 p). El seguimiento medio fue de 48,5 meses. La edad promedio de los p fue de 68 años, 37% fueron mujeres y 10% pertenecían a minorías raciales y étnicas.
La FA paroxística estuvo presente el 42% de los p, y el 80% de los p tenían algún factor de riesgo cardiovascular.
De los p asignados a ablación el 90% se la realizó. El 19% de estos fue sometido a otro procedimiento. El 44% de los pertenecientes a este grupo recibió fármacos antiarrítmicos pero sólo el 26% al final del seguimiento.
El 99% de los p asignados a fármacos los recibieron, Hubo un 27% de cruzamiento al grupo intervención.
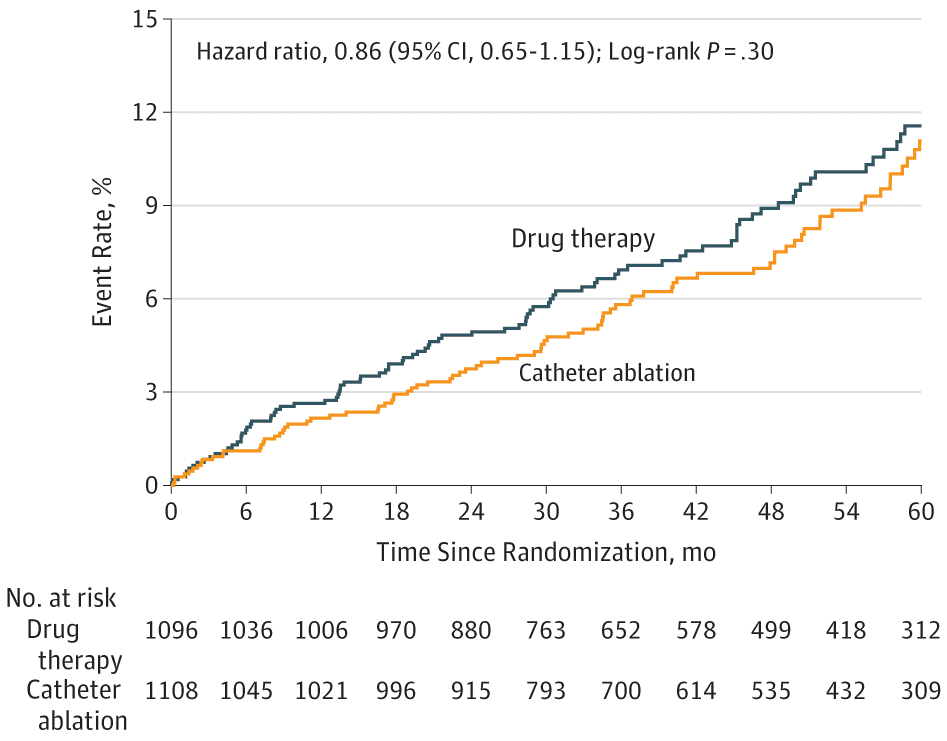
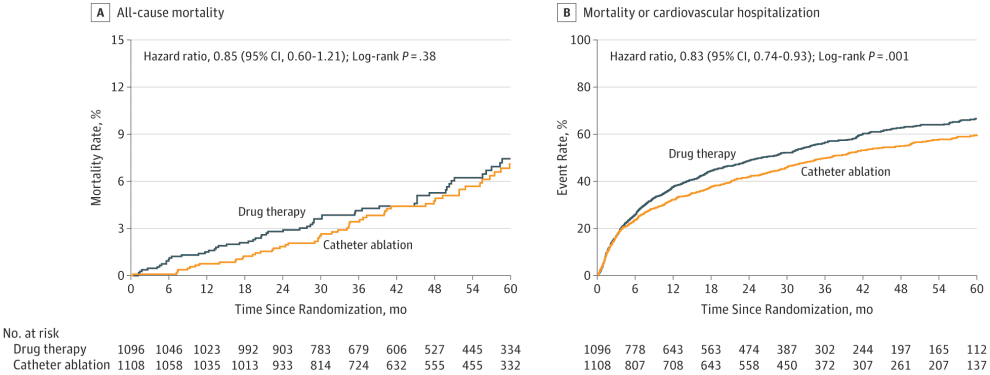
Según el análisis por intención de tratar, el punto final primario no tuvo diferencias en ambos grupos el hazard ratio (HR) fue 0,86 (p=0,3). (Fig. 1) Tampoco la hubo para los puntos finales secundarios excepto para el combinado de Mortalidad y Hospitalización Cardiovascular HR 0,83 (p=0,001). (Fig. 2).
Sin embargo según el análisis por tratamiento recibido el HR del punto final 1° fue de 0,67, para mortalidad por todas las causas fue de 0,60 y para el combinado de muerte y hospitalización CV fue de 0,83, todos con p significativas.
En 1240 p con grabador de eventos la disminución de recurrencia post blanking fue del 48% (p=0,001) a favor de la ablación.
Los efectos adversos fueron infrecuentes, en el grupo ablación hubo un 0,8% de taponamiento cardíaco y en el grupo farmacológico los desórdenes tiroideos fueron reportados en el 1,6% mientras que la proarritmia en el 0,8%.
Discusión:
Luego de 8 años de espera se publicaron los datos del estudio CABANA. Es el primer estudio randomizado que comparó la ablación por catéter y el tratamiento médico para puntos finales duros como muerte, ACV discapacitante, sangrado serio y paro cardíaco en pacientes con FA.
Cabe aclarar que el punto final primario original era mortalidad pero fue cambiado por el combinado por una enmienda en el 2013 debido al lento enrolamiento y a la baja tasa de eventos en el grupo farmacológico.
Si bien se calculó un cruzamiento del 25%, la falta de cumplimento de la ablación en el 9,2% podría haber afectado los resultados del estudio.
El análisis por intención de tratar es la única forma que garantiza la comparación de los grupos y los eventos sufridos por ellos. Por lo tanto, esta apreciación convierte al CABANA en un estudio negativo.
Sin embargo el estudio no deja de ser importante, ya que avala la actual indicación de la Ablación de FA en pacientes sintomáticos debido a la menor recurrencia en comparación con el tratamiento médico sin una alta tasa de complicaciones graves.
Figura 1
Figura 2
Traducido de Packer DL, et al. Effect of Catheter Ablation vs Antiarrhythmic Drug Therapy on Mortality, Stroke, Bleeding, and Cardiac Arrest Among Patients With Atrial Fibrillation: The CABANA Randomized Clinical Trial. JAMA. 2019;321(13):1261-1274.
ARTÍCULOS COMENTADOS POR COMITÉS
Comité de Imágenes no invasivas 2019
Autor: Nicolás Taraborrelli
INTRODUCCIÓN
El Foramen Oval es una estructura obligada durante la vida fetal, que permite el paso de sangre oxigenada placentaria hacia las cavidades izquierdas y en consecuencia, hacia la circulación sistémica. Esto está facilitado por la Válvula de Eustaquio (estructura del ostium derecho del seno venoso) que dirige el flujo placentario hacia la fosa oval. Luego del nacimiento y con el cambio de presiones se produce un cierre funcional para luego terminar en su cierre anatómico al fusionarse los septum primum y secundum, tomando la forma adulta de la circulación.
La prevalencia del Foramen Oval Permeable (FOP) durante la vida adulta es, según las series, entre 20 y 32% de los pacientes.
En 1881 Zahn usa por primera vez el término “Embolia Paradojal” al encontrar en una necropsia, un trombo de la vena uterina cruzando por un FOP por el cual “podía introducir tres dedos”.
Una gran serie de síntomas son atribuidos al FOP: desde los primeros reportes de enfermedad neurológica por descompresión en buzos militares1, embolias sistémicas, el síndrome platipnea ortodesoxia, pasando por cierta responsabilidad en la génesis de la migraña con aura. Sin embargo, en los últimos años, se le ha dado relevancia a la condición que reviste más jerarquía por su impacto médico y socioeconómico, debido a la población a la que afecta: el stroke criptogénico.
Si bien los primeros reportes de cierre del FOP datan de 1992, los primeros estudios con cierre percutáneo comienzan su reclutamiento en 2003.
Los estudios pioneros: CLOSURE 1 y PCI fallaron en demostrar un beneficio del cierre percutáneo sobre la terapia médica con antiplaquetarios en la prevención secundaria del stroke.
Son varios los motivos que se postulan para este fracaso.
El principal radica en que la selección de los pacientes incluidos no fue lo suficientemente estricta en descartar causas no cardioembólicas del stroke. Además, cabe comentar que el dispositivo utilizado en el estudio CLOSURE 1 no existe más en el mercado, en parte debido a su alta tasa de trombosis en su faz izquierda.
Los resultados a largo plazo del estudio RESPECT 3 mostraron cierto beneficio con el cierre mediante dispositivo Amplatzer PFO.
Desde entonces, los investigadores se han enfocado en la correcta selección de pacientes, con la premisa de que un cierre del FOP podría prevenir un stroke, solo si este estaba producido por un embolismo paradojal.
Es así que los estudios más recientes (CLOSE, REDUCE, DEFENSE PFO) mostraron francas reducciones en la incidencia de nuevos strokes en pacientes seleccionados.
Y he aquí el meollo de la cuestión: ¿Cómo seleccionar los pacientes?
Escapa a esta reseña el análisis pormenorizado de la metodología utilizada en cada trial, pero es importante destacar que los estudios que mostraron beneficios en el cierre del FOP, lo hicieron a expensas de la inclusión de aquellos pacientes con stroke criptogénico en los cuales la sospecha del FOP como causa probable era alta.
Esto se hizo al descartar causas no cardioembólicas (lesiones carotídeas o aórticas, lesiones intracraneales), la presencia de arritmias embolígenas (FA/AA) y/o aplicando el score RoPE (Risk of Paradoxical Embolism) 5 y evaluando las características del FOP (Tabla 1).
Tabla 1: Score RoPE (Risk of Paradoxical Embolism)
| Características | Puntos | Score RoPE |
| Sin historia de HTA | 1 | |
| Sin historia de DBT | 1 | |
| Sin historia de Stroke o AIT | 1 | |
| No fumador | 1 | |
| Imágenes de infarto cortical | 1 | |
| Edad, años | ||
| 18-29 | 5 | |
| 30-39 | 4 | |
| 40-49 | 3 | |
| 50-59 | 2 | |
| 40-69 | 1 | |
| >= 70 | 0 | |
| Puntaje total
(suma de los puntos individuales) |
||
| Score Máximo | 10 | |
| Score Mínimo | 0 |
Traducido de Kent DM, et al. An index to identify stroke-related vs incidental patent foramen ovale in cryptogenic stroke. Neurology. 2013 Aug 13;81(7):619-25.
FISIOLOGÍA
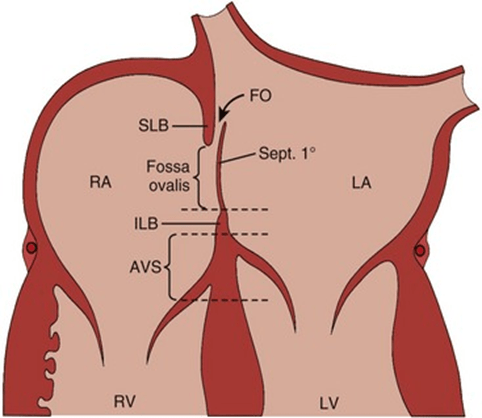
El septum primum y el septum secundum no fusionados forman una estructura “valvulada” (Ilustración 1) que solo permite el shunt de derecha a izquierda. Ya que las presiones de la Aurícula Izquierda son más altas durante la mayor parte del ciclo cardíaco, las situaciones que aumenten la presión en la AD son las que permiten el paso de sangre: maniobra de Valsalva, tos, estornudos, etc.
Ilustración 1: Anatomía del Foramen Oval Permeable. Nótese como, a partir de su mecanismo valvulado, la dirección del shunt solo puede ser de derecha a izquierda. Extraído de Keane JF, et al. Nada´s Pediatric Cardiology, 2nd ed. Philadelphia: Elsevier/Saunders, 2006
Las pequeñas microtrombosis de las venas soleas, se limpian en el filtro de la circulación pulmonar, así como los gases microcavitados lo hacen en el mismo lugar por difusión. Sin embargo, al existir un shunt transitorio de derecha a izquierda, el riesgo de embolia paradojal es real.
Es así como se postula que su relación con la cefalea migrañosa con aura estaría debida a microtrombosis paradojal cerebral persistente y liberación de sustancias vasoactivas que desencadenarían las crisis.
El estudio CLOSE (2) sugiere ciertas características del FOP que lo hacen de alto riesgo embólico: La presencia de un shunt severo, la asociación con grandes aneurismas del Septum Interauricular y un diámetro mayor a 2-4 mm.
DIAGNÓSTICO
El gold standard para el diagnóstico de FOP es la ecografía transesofágica con salino agitado. El ETE es un estudio invasivo, con una incidencia de complicaciones que si bien es baja, no es nula. Además, el estudio se realiza bajo sedación, lo que impide la colaboración del paciente en la realización de maniobras que aumenten la presión en la AD.
En nuestra experiencia (y coincidente con reportes de otros laboratorios) encontramos que la ecografía trastorácica con salino agitado (Estudio de burbujas) nos permite un óptimo nivel diagnóstico.
Durante la fase de descompresión de la maniobra de Valsalva evaluamos la presencia de burbujas en cavidades izquierdas, con una visualización óptima.
Dejamos el ETE para los casos donde se decide el cierre, para la medición de bordes y durante el procedimiento de colocación del dispositivo.
Tabla 2: Diferencias entre el foramen oval permeable y la comunicación interauricular.
| Foramen Oval Permeable | Comunicación Interauricular | |
| Anatomía | La falla en la fusión de los septum primum y secundum lleva a un mecanismo valvulado en el septum interauricular. | Deficiencia en el cierre del Septum Interauricular. Es un “agujero” septal. |
| Shunt | Shunt de derecha a izquierda cuando las presiones de la aurícula derecha, exceden a las de la izquierda (generalmente transitorio) | Shunt contínuo de izquierda a derecha |
| Prevalencia | 20–34% de la población adulta | 1,6 cada 1000 nacidos vivos |
| Consecuencias | Sin trascendencia en la mayor parte de los pacientes, aunque puede permitir embolia paradojal | El shunt contínuo de izquierda a derecha causa sobrecarga de volumen del corazón derecho, que puede terminar reduciendo la sobrevida si no es corregido. Puede incrementar las presiones pulmonares, reducir la tolerancia al ejercicio y favorecer la aparición de arritmias. |
Traducido y modificado de Giblett JP, et al. Patent Foramen Ovale Closure in 2019. Interv Cardiol. 2019;14(1):34–41.
TRATAMIENTO
La persistencia del Foramen Oval Permeable es una condición extremadamente frecuente que afecta a casi un cuarto de la población. Este hallazgo aislado, no es causa per se de aumento de la incidencia de stroke. Es escasa (si no nula) la evidencia en prevención primaria de la embolia paradojal en estos pacientes. Un estudio pequeño y no randomizado 6 propuso criterios de alto riesgo de embolia paradojal, que pudieran justificar la prevención primaria con antiplaquetarios. Los criterios CARPE (Foramen oval grande, shunt derecha a izquierda espontáneo, aneurisma septal, anomalías de la coagulación y válvula de Eustaquio prominente) seleccionan una población en la cual, de existir la combinación de estas anomalías, la incidencia de stroke por embolia paradojal es mayor. Aún no hay evidencia de calidad que justifique la antiagregación preventiva en pacientes que no han tenido eventos. Sin embargo aquellos pacientes que han tenido stroke y se sospeche que el origen sea embolia paradojal, la evidencia sugiere un beneficio con el cierre percutáneo sobre la antiagregación.
BIBLIOGRAFÍA
1 Bove AA. Risk of decompression sickness with patent foramen ovale. Undersea Hyperb Med. 1998;25(3):175-8.
- Mas JL, Derumeaux G, Guillon B, et al. Patent foramen ovale closure or anticoagulation vs. antiplatelets after stroke. New England Journal of Medicine, 377(11), 1011-1021.
- Saver JL, Carroll JD, Thaler DE, et al. Long-term outcomes of patent foramen ovale closure or medical therapy after stroke. New England Journal of Medicine, 377(11), 1022-1032.
- Giblett JP, Abdul-Samad O, Shapiro LM, et al. Patent Foramen Ovale Closure in 2019. Interv Cardiol. 2019;14(1):34–41.
- Kent DM, Ruthazer R, Weimar C, et al. An index to identify stroke-related vs incidental patent foramen ovale in cryptogenic stroke. Neurology. 2013 Aug 13;81(7):619-25.
- Rigatelli G, Dell’Avvocata F, Giordan M, et al. Embolic implications of combined risk factors in patients with patent foramen ovale (the CARPE criteria): consideration for primary prevention closure.J Interv Cardiol.2009;22(4):398-403.
- Keane JF, et al. Nada´s Pediatric Cardiology, 2nd ed. Philadelphia: Elsevier/Saunders, 2006
ARTÍCULOS COMENTADOS POR COMITÉS
Comité de Cirugía y Recuperación Cardiovascular 2019
Dra. Verónica Lenarduzzi
¿CÓMO PODRÍAMOS DEFINIR EN UN POSOPERATORIO DE CIRUGÍA CARDÍACA UN SÍNDROME DE BAJO GASTO CARDÍACO?
“El síndrome de bajo gasto cardiaco (SBGC) puede ser definido por la incapacidad del corazón para suplir las demandas tisulares de oxígeno. Esta condición desvía el metabolismo celular hacia la anaerobiosis, incrementando los valores de caído láctico en sangre, situación que perpetua en el tiempo, llevara al fallo multiorgánica y muerte celular”.1
¿Cuál sería su incidencia? 2
La incidencia del SBGP es variable en las distintas series publicadas, desde 4% hasta 15%, con una mortalidad que se aproxima al 20%. Si bien en enfermos mayores de 70 años el síndrome puede estar presente hasta en un 63%, a pesar del desarrollo de mejores técnicas de cardioprotección y cuidados transoperatorios, la incidencia de este síndrome en poblaciones de alto riesgo no se ha modificado en una proporción significativa.
¿Cuáles son los predictores preoperatorios de complicaciones posoperatorias?
Son similares a los predictores de mortalidad. En orden descendente de relevancia se incluyen:
- Re operación.
- Cirugía de emergencia.
- Necesidad de balón de contra pulsación intraórtica
- Insuficiencia cardíaca preoperatoria/ deterioro severo de la función ventricular.
- Cirugía combinada.
- Edad mayor de 75-80 años 3
La disfunción renal preoperatoria el tiempo prolongado de circulación extracorpórea y la resistencia vascular pulmonar elevada >3U/Wood, constituyen variables de peor pronóstico en pacientes operado en cirugía cardiaca valvular, asociados a una mayor probabilidad de sufrir esta complicación. 4
¿Cómo se diagnostica?
- SBGC pos cirugía: presenta un índice cardiaco <2,2 l/mi/m2, sin hipovolemia relativa asociada, presión de enclavamiento mayor a 20 mmhg durante 6 horas y un aumento de las resistencias vasculares sistémicas (RVS) mayor a 1.500 dinas /seg/cm -5, parámetros obtenidos con catéter de Swang –Ganz. (2) Puede deberse al fracaso ventricular derecho y/o izquierdo y asociar o no congestión pulmonar. Puede cursar con presión arterial normal o baja.
- Que presenten un cuadro clínico de bajo gasto cardiaco: oliguria (diuresis inferior a 0,5 ml/kg/ h, saturación venosa central inferior < 60% (con saturación arterial normal) y/o lactato >3mmol/l, sin hipovolemia relativa y una diferencia arteriovenosa mayor de 5,5 ml/dl. 3 Dentro de este grupo se deben incluir a los pacientes que vienen de quirófano con inotrópico y/ balón de contra pulsación intraaortica y esto han de mantenerse para conseguir una situación hemodinámica estable.
- Shock cardiogénico: corresponde la situación más grave del espectro del SBGC. Se define como IC<2.0l/min/m2, con una presión arterial sistólica PA<90 mmhg, sin hipovolemia relativa y con oliguria.5
¿Qué mecanismos debo pensar que me pueden desarrollar un síndrome de bajo volumen minuto?6
El SVBGC como expresión de shock en el postoperatorio de cirugía cardiovascular puede ser secundario a múltiples etiologías que pueden estar dentro y/o fuera del corazón y muchas de ellas no se van a resolver con el sostén hemodinámico con inotrópicos, incluso pueden empeorar el cuadro o retrasar el diagnostico.
¿Cuáles serían las causas fuera del corazón?
Entre ellas tendríamos tromboembolia de pulmón, neumotórax hipertensivo, hipotermia, hipotiroidismo.
¿Cuáles son las causas intraoperatorias?
Sangrado médico quirúrgico, dificultad de salida de circulación extracorpórea cardiaca, reacción por protamina, insuficiencia suprarrenal, tórax leñoso.
Por lo regular, cuando el paciente se somete a una cirugía cardiaca en la que se utiliza la bomba de circulación extracorpórea existe una disminución de la función ventricular posoperatoria que tiene su pico máximo entre las 8 y 12 h posteriores al procedimiento; la función ventricular se recupera de modo gradual a partir de las 24 h y se normaliza hasta el séptimo día.
¿Cuáles serían las causas dentro del corazón con función sistólica conservada?
Aumento del gradiente intraventricular por OTSVI, taquiarritmias, bradiarritmias, taponamiento cardiaco, complicaciones mecánicas (CIV o insuficiencia mitral aguda por rotura de cuerda tendinosa o funcional isquémica).En ocasiones, el sostén con inotrópicos en forma empírica sin tener aun el diagnóstico etiológico del shock retrasara el tratamiento definitivo.-
¿Cuáles serían las causas dentro del corazón con la función sistólica deteriorada?
Infarto agudo de miocardio peri operatorio, falla del ventrículo derecho, deterioro grave de la función sistólica del ventrículo izquierdo. En dichas situaciones podrán ser útiles los inotrópicos con medidas de sostén temporal hasta lograr la solución definitiva.
El SBGC que se produce en posoperatorio inmediato, podría ser considerado como una insuficiencia cardíaca aguda y compleja, en las que están presentes de mayor a menor medida, los componentes cardiogénicos, distributivos e hipovolémicos. Generalmente es transitorio y reversible y se produce una recuperación paulatina en 24-48 horas aproximadamente; sin embargo en otras ocasiones conduce a la falla multiorgánica e incluso a su exponente más grave, la muerte del paciente.
Trae acompañado la prolongación de los tiempos de monitorización, la ventilación mecánica, la estancia a UCO y la mortalidad que puede elevarse hasta 15% – 20%.7
¿Qué patrón hemodinámico predomina?
Los pacientes con bajo gasto cardíaco presentan un patrón hemodinámico de tipo hipo dinámico o frio, con mala perfusión periférica, presiones de llenado normal o altas, volumen minuto bajo, resistencias periféricas elevadas, saturación mixta venosa baja, diferencia arteriovenosa alta, ácido láctico aumentado. Dentro de este grupo, se incluyen varios subtipos con SBGC por disfunción sistólica, taponamiento cardiaco y falla de ventrículo derecho.8
¿Cuáles son las claves para el tratamiento de SBGC?9
- Evaluar todos los factores preoperatorios que podrán favorecer el SBGC (deterioro de la función sistólica del VI, HTP previa, etc.).
- Corregir causas no cardiacas: anemia, trastornos hidroelectrolíticos, acidosis, hipercapnia, etc.
- Optimizar la precarga de ambos ventrículos.
- Evitar y/o tratar arritmias. Mantener una conducción AV y contracción auricular. Es ideal una frecuencia cardiaca de 80- 100 l /min.
- Usar inotrópicos si el índice cardiaco es < 2,2 l/min/m2. El inotrópico elegido debe ser coherente con el escenario hemodinámico:
- Si la Hipertensión Pulmonar (HTP) o las resistencias vasculares sistémicas están elevadas (RVS), es preferible: dobutamina, milrinona, levosimendán.
- Si RVS o Resistencias vasculares pulmonares bajas (síndrome de respuesta inflamatorias): dopamina, noradrenalina.
- Evitar la hipertensión arterial (nitroprusiato con precarga adecuada, nitroglicerina con precarga elevada.
- Optimizar la precarga del ventrículo derecho y disminuir su poscarga.
- Balón de contrapulsación intraaórtica (BCIA) si no hay mejoría.
- Tratar la isquemia: Nitroglicerina, diltiazem (si hay vasoespasmo), cinecoronariorografía, BCIA. Eventualmente angioplastia percutánea o re-CRM.
- Asistencia ventricular o biventricular.
Conclusiones:
El síndrome de bajo gasto cardíaco es la expresión más grave de un shock cardiogénico en el postoperatorio de cirugía cardíaca, pero no siempre se asocia con déficit inotrópico del corazón, aumentando así la morbimortalidad, que puede ser evitado en algunas ocasiones.
Unos de los pilares para el manejo exitoso de esta patología son:
- Conocer al paciente,
- Conocer qué tipo de cirugía,
- Interpretar correctamente los datos de laboratorio, Ecg , Rx tórax , ecocardiograma , Swan-Ganz ,
- Adelantarse a las complicaciones y
- Conocer qué tipo de tratamiento abordar.
Bibliografía:
- Giorgini JC, Comignani P. “Síndrome de bajo volumen minuto. Recuperación cardiovascular”. Publicación científica del Consejo Argentino de Residentes de Cardiología- 2010 , Sec. III, p. 214-221
- Guía Práctica basada en la evidencia para el manejo postquirúrgico del paciente llevado a cirugía cardíaca. Vol. 81, Suplemento N°2. Síndrome de bajo gasto cardíaco postcardiotomía. ARC. Cardiología MEX. -2011, Vol. 81 Suplemento N°2, p. 30-40.
- Giorgini JC, Comignani P. ; ob. cit. p. 214.
- Predictores de bajo gasto cardíaco perioperatorio en pacientes operados en cirugía valvular. Corsalud. Agosto del 2018, p. 286-293.
- Perez Vela JL, Martin Benitez JC, Carrasco Gonzalez M, et al. Guía práctica para el manejo del síndrome de bajo en el postoperatorio de cirugía cardíaca. 23 de marzo del 2012. p.e4-e5.
- Bilbao J. Cirugía cardiovascular. Un modelo biológico de los distinto tipos de shock. Prosac- 2014, módulo 10, fascículo n°2, p. 67.
- Perez Vela JL, Martin Benitez JC, Carrasco Gonzalez M, et al. ob. cit.; p. e5
- Benzadon, Mariano. Algoritmos en el postoperatorio de cirugía cardiovascular. Cap. 1, p. 5, año 2012.
- Giorgini J, Comignani P. Recuperación Cardiovascular. Síndrome de bajo minuto. Tabla 4, p. 220, año 2010.
ARTÍCULOS COMENTADOS POR COMITÉS
Comité de Unidad Coronaria y Cardiopatía Isquémica.
Antithrombotic therapy after acute coronary syndrome or PCI in atrial fibrillation Lopes RD et al. N Engl J Med. 2019 Apr 18;380(16):1509-1524.
Elegir tratamiento antitrombótico para pacientes con fibrilación auricular (FA) que tienen un síndrome coronario agudo (SCA) o que requieren una intervención coronario percutánea (PCI) constituye un reto.
La anticoagulación oral está indicada para prevenir cardioembolia sistémica en pacientes con FA, pero no ha demostrado prevenir la trombosis del stent y tampoco está indicado para prevención secundaria después del SCA como coadyuvante en el tratamiento antiplaquetario dual. La combinación de agentes antitrombóticos, especialmente la triple terapia con anticoagulación oral aumenta el riesgo de sangrado. (1-2)
El ensayo actual fue diseñado específicamente para ver el efecto independiente de anticoagulante y el tratamiento antiplaquetario.
MÉTODO
Es un estudio internacional con un diseño factorial de dos por dos, donde se asignaron al azar pacientes con FA paroxística, permanente o persistente, que tenían un SCA o PCI y que estaban
planeando tomar un inhibidor de P2Y12 por al menos 6 meses a recibir apixabán o un antagonista de vitamina K y para recibir aspirina o placebo durante 6 meses. Los pacientes que habían sido
randomizados a la rama de apixabán fueron asignados a recibir 5 mg dos veces al día o a 2,5 mg dos veces al día si tenían, 80 años de edad, peso de 60 kg o menos y un nivel de creatinina de
1,5 mg/dl . En los pacientes que fueron randomizados a la rama de anti-vitamina K la dosis se ajustó según RIN (international normalized ratio) con un rango de 2.0 a 3.0. Al mismo tiempo los
pacientes fueron asignados recibir bajas dosis de aspirina 81 mg o placebo una vez al día.
Aquellos que usaban anticoagulación oral por otra causa (ej. válvula protésica, tromboembolismo venoso y estenosis de válvula mitral) fueron excluidos, como también pacientes con insuficiencia
renal severa, historia de hemorragia intracraneal, reciente o planeada CRM, coagulopatía u otro riesgo de sangrado. También a quienes tuvieran contraindicación para antagonistas de la vitamina K, apixabán y cualquiera de los P2Y12 o aspirina. Los riesgos de apoplejía y sangrado fueron evaluados con el uso de dos puntajes de CHA2DS2-VASc y de HAS-BLED.
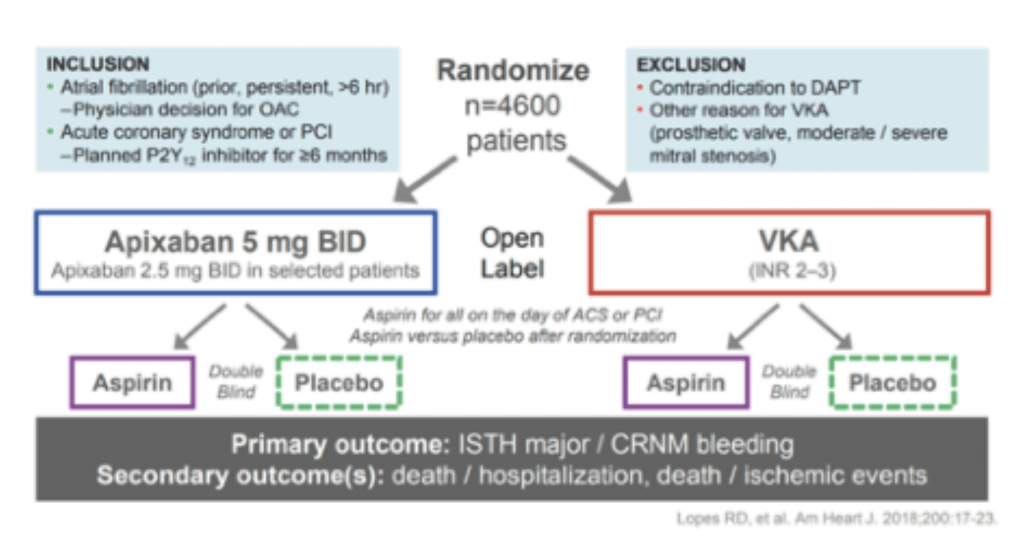
El end point primario fue hemorragia mayor o sangrado no mayor clínicamente relevante definido por La International Society on Thrombosis and Haemostasis (ISTH) como aquel resulta en la
muerte o que ocurre en órgano crítico (intracraneal, intraespinal, intraocular, retroperitoneal, intraarticular, intramuscular con síndrome compartimental o pericárdico), o a cualquier sangrado asociado a descenso del nivel de hemoglobina de 2g/dl o a una transfusión de al menos 2 unidades de glóbulos rojos. (3) Sangrado no mayor clínicamente relevante definido como, el que resulta en hospitalización, que requiere intervención médica o quirúrgica, o que cambia las directivas de la terapia antitrombótica y que requiere reprogramar una nueva visita al protocolo. El sangrado fue también clasificado de acuerdo the Global Use of Strategies to Open Occluded Arteries (GUSTO). (4) El end point secundario incluyó dos ítems, el compuesto de muerte más hospitalizaciones y una combinación de muerte más eventos isquémicos (stroke, infarto de miocardio, thrombosis intrastent definida o probable y CRM de urgencia).
También se exploraron cada uno de los puntos secundarios en forma independiente. El trial fue sponsoreado por Bristol-Myers Squibb y Pfizer.
RESULTADOS
Se enrolaron 4614 pacientes desde septiembre de 2015 hasta abril de 2018, de 492 centros de 33 países dentro de 14 días después de tener un SCA o PCI, tan pronto como fuera posible luego de suspendida la anticoagulación parenteral. La edad media entre todos los pacientes fue 70.7 años y el 29% eran mujeres.
Mil setecientos catorce de 4595 que se distribuyeron por azar (37,3%) tuvieron un síndrome coronario agudo y PCI, mientras que 1097 (23,9%) fueron sometidos a tratamiento médico y 1784 (38,8%) a PCI electiva. La media CHA2DS2-VASc score fue 4 (rango interquartilo 3 a 5) y la media HAS-BLED score fue 3 (rango intercuartilo 2 a 3).
Clopidogrel fue el inhibidor de P2Y12 más usado en el 92,6%. El 10% del grupo asignado a recibir apixabán recibió la dosis de 2,5 mg dos veces al día. El porcentaje medio de tiempo en el rango
terapéutico fue 59% entre los pacientes asignados a recibir un antagonista de la vitamina K un 3% tuvieron un RIN por encima de 3 y un 23% estuvieron por debajo 2.
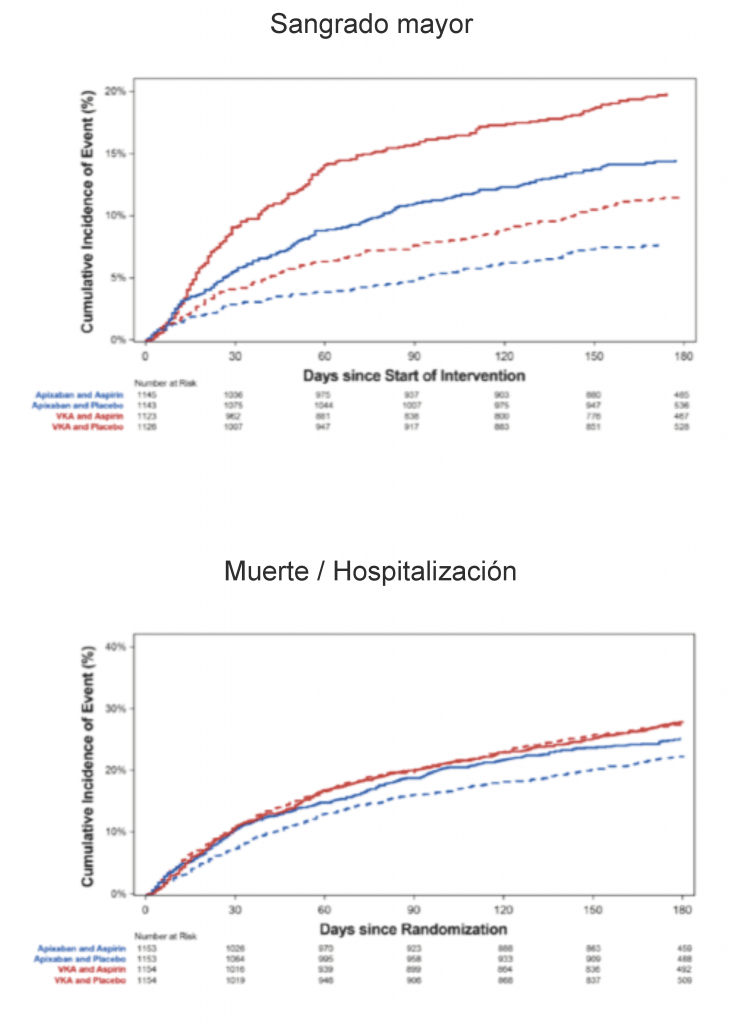
Con respecto al end point primario, se observó una hemorragia mayor o no mayor pero clínicamente relevante en el 10,5% de las pacientes que recibieron apixabán, en comparación con el 14,7%
de los que recibieron vitamina K antagonista (índice de riesgo, 0,69; intervalo de confianza [IC] del 95%, 0,58 a 0,81; P <0,001 tanto para la no inferioridad como para la superioridad). El número necesario a tratar durante un período de 6 meses para evitar un sangrado mayor o clínicamente relevante con apixabán en lugar de una antagonista de la vitamina K fue de 24.
Se observó una hemorragia mayor o no mayor pero clínicamente relevante en el 16,1% de los pacientes que recibieron aspirina, en comparación con el 9% de los que recibieron placebo, la tasa de eventos fue significativamente más alta entre los que recibían aspirina que entre los que recibieron placebo (índice de riesgo, 1,89; IC del 95%, 1,59 a 2,24; P <0,001). El número necesario para tratar durante un período de 6 meses y causar un sangrado mayor o no mayor, pero clínicamente relevante con aspirina en lugar de placebo fue de 14.
El porcentaje de pacientes con sangrado mayor fue más alto entre quienes recibían antagonistas de la vitamina K más aspirina (18,7%) y menor entre quienes recibían apixabán más placebo (7,3%). Efectos similares se observaron con respecto a hemorragia mayor y para sangrado evaluado con el uso de otras escalas.
Con respecto a los end point secundarios, los pacientes del grupo de apixaban tuvieron menor incidencia de muerte u hospitalización que las del grupo antagonista de la vitamina K (541 vs 632, o sea el 23,5% vs. 27,4%; relación de riesgo, 0,83; IC
del 95%, 0,74 a 0,93; P = 0,002) La diferencia entre grupos fue debida fundamentalmente a una menor incidencia de hospitalización (518 pacientes [22,5%]
en el grupo de apixabán vs 607 [26,3%] en el grupo antagonista de la vitamina K) mientras que la frecuencia de muertes fueron similares. Con una incidencia similar, el régimen de comparación de antiplaquetarios 604 vs 569 o sea el 26,2% vs 24,7% del grupo aspirina vs placebo murieron o fueron hospitalizados (hazard ratio, 1,08; 95% CI,
0,96 a 1,21). La mayor incidencia acumulada de muerte u hospitalizaciones a 6 meses se vio en el grupo de pacientes que habían sido asignados a recibir antagonistas de la vitamina K y aspirina (27,5%) y menor en quienes fueron asignados a recibir apixabán más placebo (22%).
En lo que respecta al end point combinado de muerte y eventos isquémicos, 154 pacientes (6,7%) del grupo asignado a apixabán vs 163 (7,1%) del grupo antagonistas de la vitamina K presentaron eventos. En comparación, del régimen antiplaquetario 149 pacientes (6,5%) del grupo de aspirina murieron o tuvieron eventos isquémicos vs
168 (7,3%) del grupo placebo. Esta diferencia no fue significativa pero más eventos isquémicos ocurrieron en el grupo placebo. Mientras que la tasa de eventos en 100 paciente por año de muerte o eventos isquémicos fue similar en el entre los
grupos del régimen anticoagulante y del antiplaquetario. La tasa de stroke fue menor entre quienes recibían apixabán que en los que recibían antagonistas de la vitamina K (hazard ratio, 0,50; 95% CI, 0,26 to 0,97).
CONCLUSIONES
En pacientes con fibrilación auricular y un reciente síndrome coronario agudo o ICP tratados con un inhibidor de P2Y12, en un régimen antitrombótico que incluyó apixabán, sin aspirina, dio lugar a menos sangrado y menos hospitalizaciones sin diferencias significativas en la incidencia de eventos isquémicos que los regímenes que incluyeron un antagonista de la vitamina K y aspirina o ambos.
COMENTARIO DE LA AUTORA
Una situación increíblemente desafiante y común en cardiología son los pacientes con fibrilación auricular que presenta un síndrome coronario agudo o que necesitan intervención coronaria percutánea.
La anticoagulación terapéutica es necesaria para que la fibrilación auricular reduzca los accidentes cerebrovasculares y el riesgo tromboembólico, mientras que la terapia antiplaquetaria dual (DAPT) se ha convertido en el estándar de atención tanto
para el SCA como para la ICP. Cómo combinar estas dos estrategias antitrombóticas ha sido una fuente de mucho debate. Muchos médicos abandonan un período de terapia antitrombótica triple con un anticoagulante oral y DAPT, pero esta estrategia se asocia con un aumento marcado en el riesgo de sangrado. AUGUSTUS es un estudio histórico que se propuso responder a esta pregunta.
Por lo tanto, la estrategia ganadora en AUGUSTUS fue básicamente apixabán más clopidogrel. Este ensayo y anteriores apoyan firmemente el abandono de una estrategia de terapia antitrombótica triple en esta población de pacientes.
La estrategia preferida es un anticoagulante oral más clopidogrel oral y no antagonista de la vitamina K, con el uso de aspirina reservado para la fase de atención hospitalaria.
REFERENCIAS
1. Hansen ML, et al. Risk of bleeding with single, dual, or triple therapy with warfarin, aspirin, and clopidogrel in patients with atrial fibrillation. Arch Intern Med 2010; 170: 1433-41.
2. Sørensen R, et al. Risk of bleeding in patients with acute myocardial infarction treated with different combinations of aspirin, clopidogrel, and vitamin K antagonists in Denmark: a retrospective analysis of nationwide registry data. Lancet 2009; 374: 1967-74
3. Schulman S, et al. Subcommittee on Control of Anticoagulation of the Scientific and Standardization Committee of the International Society on Thrombosis and Haemostasis.
Definition of major bleeding in clinical investigations of antihemostatic medicinal products in non-surgical patients. J Thromb Haemost 2005; 3: 692-4.
4. The GUSTO Investigators. An international randomized trial comparing four thrombolytic strategies for acute myocardial infarction. N Engl J Med 1993; 329: 673-82.